Centrum buněčné terapie a tkáňových náhrad UK (CBTTN) má za sebou sedm let své existence. První čtyři roky jako centrum základního výzkumu (typ A) a ve 2. etapě již jako centrum kladoucí důraz také na aplikace (typ B). Ve stávajícím centru proto 10 % prostředků poskytují spolupracující firmy. Nepochybně se ukázalo, že pro CBTTN je myšlenka zakládání center základního a aplikovaného výzkumu začátkem úspěšné mezioborové spolupráce vedoucí nejen k excelentním výsledkům základního výzkumu, ale i k výzkumu aplikovanému, jehož výsledkem jsou konkrétní inovační kroky, jako je např. vznik Inovačního biomedicínského centra ÚEM z projektu JPD2.
Finanční prostředky centrům poskytuje MŠMT a podporu UK, AV ČR a MZ ČR. Centrum má své sídlo v Ústavu neurověd 2. lékařské fakulty UK. Zakládajícími partnery jsou již zmíněný Ústav neurověd 2. lékařské fakulty UK, Ústav experimentální medicíny AV ČR (ÚEM), Ústav makromolekulární chemie AV ČR (ÚMCH), Ústav živočišné fyziologie a genetiky AV ČR (ÚŽFG) a Institut klinické a experimentální medicíny (IKEM). Ve druhé etapě přistoupil k Centru Ústav hematologie a krevní transfúze (ÚHKT). V rámci UK však spolupracuje i s dalšími ústavy a klinikami (viz obr. 1).Mezi institucemi sdruženými v Centru existuje významná spolupráce. Vznikla řada společných publikací, nové společné granty, společné patenty a klinické zkoušky. V centru se každoročně mezioborově školí 25–30 doktorandů. Na základě výsledků je též partnerem mnoha projektů 6. RP EU i 7. RP EU (např. STEMS, RESCUE, Angiotargeting, DIMI, ESTOOLS). Tento stručný přehled si neklade za cíl uvést výčet výsledků základního výzkumu, ale především upozornit na výsledky a projekty mezioborové spolupráce subjektů v CBTTN, na jejichž základě vznikla klinická zkouška nebo patentová přihláška. Výsledky výzkumu se mohou přímo uplatnit v regenerativní medicíně – novém lékařském oboru, který využívá tzv. moderní metody, mezi něž patří především kmenové buňky, tkáňové náhrady, molekulární a diagnostické zobrazovací metody, biomateriály a nanotechnologie. Tím se projekt CBTTN zařazuje do projektu Road Map EU – ESFRI Translační medicína.
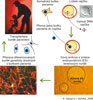
Výjimečná vývojová kapacita embryonálních buněk, spolu s možností jejich dlouhodobého množení v podmínkách in vitro, řadí lidské embryonální buňky mezi nejnadějnější nástroje buněčné terapie, a jejich výzkum byl proto stanoven jako jedna z prioritních aktivit CBTTN. Díky mnohaletým zkušenostem s manipulací s embryonálními buňkami myšího původu se doc. P. Dvořákovi a doc. A. Hamplovi v CBTTN podařilo ustavit první linie lidských embryonálních buněk již na jaře r. 2003, díky čemuž se ČR stala jednou z prvních zemí na světě, kde se tento výzkum začal rozvíjet. Celkem se podařilo ustavit sedm nezávislých linií, které se v současnosti v rámci CBTTN využívají k mnoha pokusům s cílem přispět k biomedicínskému využití těchto buněk. Největší pozornost je věnována odhalování molekulárních faktorů zodpovědných za množení lidských embryonálních buněk v nediferencovaném stavu a společně se skupinou prof. E. Sykové indukci jejich vývoje do medicínsky atraktivních buněčných typů. Vzhledem k tomu, že jednou z klíčových otázek klinického použití lidských embryonálních buněk je otázka jejich bezpečnosti z hlediska možného nádorového růstu po implantaci, zabývají se vědci v CBTTN schopností lidských embryonálních buněk reagovat na poškození jejich genetické informace. Tři vybrané linie lidských embryonálních buněk ustavené v ČR jsou zařazeny do celosvětové srovnávací studie, které se vědci CBTTN aktivně účastní. Výsledkem její první dvouleté fáze je práce publikovaná v r. 2007 v časopise Nature Biotechnology, která zásadně přispívá k nalezení molekulárních a funkčních charakteristik embryonálních buněk. Pro pochopení molekulárních základů jejich diferenciace použili v ÚŽFG nejmodernější proteomovou analýzu. Tyto výsledky představují důležitý krok k identifikaci regulačních proteinů, které řídí diferenciaci nervových kmenových buněk. Dr. J. Fulka a Ing. I. Vacková se věnují studiu embryonálních buněk na zvířecích modelech. Cílem je ustavit linie, na kterých by bylo možné ověřit bezpečnost využití kmenových buněk v medicíně. Důraz kladou na terapeutické přenosy jader s cílem vytvořit kompatibilní buňky přímo pro pacienta (viz obr. 2). Zabývají se mezidruhovým přenosem jader, aby bylo možné eliminovat nedostatek humánních oocytů, případně vytvářet linie buněk s určitým defektem. V nedávno vyšlé práci publikované v časopise Science ukázali, že jadérko v embryích je čistě maternálního původu. Je-li jadérko z oocytu odstraněno, není ho možné nahradit jadérkem ze somatické buňky. Úloha vejce je tedy při reprodukčním i terapeutickém klonování mnohem větší, než se původně předpokládalo. Výsledky se významně uplatní při přenosu jader – terapeutickém klonování.
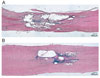
V ÚEM vzniklo Oddělení buněčné terapie a tkáňových náhrad, které rozvinulo modely onemocnění mozku a míchy. Výsledky pokusů na modelech ischemie mozku a poranění míchy prokázaly, že jak embryonální, tak dospělé kmenové buňky z kostní dřeně, tukové tkáně či pupečníkové krve migrují do místa léze. Buňky v lézi přežívají a buď se zde diferencují v neurony a gliové buňky, nebo uvolňují faktory, které zachrání neúplně poškozenou tkáň tím, že zabraňují buněčné smrti, uvolňují růstové faktory a cytokiny, jež podporují regeneraci, vedou ke zmenšení léze a k funkčnímu zlepšení. U míšního poranění pak bude nutné pro eventuální léčbu využít přemostění defektu, např. pomocí hydrogelů nebo nanovláken osázených vhodnými kmenovými buňkami. Počítá se také s využitím různých typů kmenových buněk, embryonálních i z dospělých tkání, např. z kostní dřeně, tukové tkáně, vlasového folikulu, čichového epitelu a dalších látek, jako jsou enzymy, inhibitory antiregeneračních faktorů a receptorů. Zvířecí model balónkové kompresní léze vyvinutý v ÚEM nyní využívá celé konsorcium v projektu 6. RP EU řešící léčbu míšního poranění pomocí kmenových buněk (RESCUE). Ukázalo se, že kmenové buňky z kostní dřeně nebo z tukové tkáně i po intravenózní aplikaci osídlí místo léze, nevytvářejí nádory a za několik týdnů se zmenší léze a zlepší motorické i senzitivní funkce. Využívají se také náročné elektrofyziologické metody ke snímání membránových proudů a ke studiu receptorů implantovaných kmenových buněk.
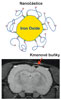
Spolupráce ÚEM, Oddělení magnetické rezonance IKEM a ÚMCH nejen prokazuje, ale podstatným způsobem inovuje možnost sledovat osud implantovaných buněk v živém organizmu po jejich označení superparamagnetickými nanočásticemi železa. Pomocí magnetické rezonance tak lze kontrolovat jejich diferenciaci, migraci a osud i v delším časovém horizontu. Úspěšně byly označeny a sledovány kmenové buňky kostní dřeně i embryonální buňky po implantaci do organizmu u modelů míšního poranění, iktu, transplantace Langerhansových ostrůvků u diabetu, dále hepatocyty a chondrocyty. Podařilo se vyvinout novou metodu pro přípravu nanočástic oxidu železa s modifikovaným povrchem a dlouhodobou koloidní stabilitou (viz obr. 3). Povrch nanočástic je z povlaků na bázi cukrů, polyaminokyselin, popř. jiných polymerů, které umožňují označit kmenové buňky podstatně účinněji než pomocí komerčně používaných částic. Postup modifikace povrchu nanočástic byl patentován (PCT/CZ2007/000012: Horák D., Syková E., Babič M., Jendelová P., Hájek M.).
Výzkum v Anatomickém ústavu 1. lékařské fakulty UK ukázal, že vlasový folikul, který je tvořen především buňkami epidermis, jež zajišťují růst a obnovu vlasu, obsahuje také buňky pocházející z neurální lišty. V časných stadiích vývoje migrují buňky neurální lišty do periferie, kde se postupně diferencují. Zjistilo se, že část buněk neurální lišty, které osídlily vlasové folikuly, zůstává v nediferencovaném stavu i v dospělosti. Ve tkáňové kultuře jsou schopné sebeobnovy a mohou se diferencovat do těch typů buněk, které za vývoje z neurální lišty pocházejí. Mají tedy vlastnosti dospělých kmenových buněk. Tyto studie vyústily v patentovou přihlášku podanou v prosinci 2006 společně se spolupracujícím pracovištěm (Dept. of Cell Biology, Neurobiology and Anatomy, Medical College of Wisconsin: Method of isolating epidermal neural crest cells, US patent 2006 0281177). Kmenové buňky izolované z vlasových folikulů myší byly transplantovány do mechanicky poškozené míchy dospělých myší stejného kmene. Přežívaly v místě léze, netvořily nádory a diferencovaly se z nich GABA-ergní neurony a oligodendroglie. Různé typy embryonálních i dospělých buněk se tedy mohou uplatnit při náhradě lokálních neuronů, astrocytů a při remyelinizaci axonů poraněné míchy. Na základě výsledků na laboratorních potkanech v ÚEM a miniaturních prasatech v ÚŽFG byla v Motole připravena jednoduchá klinická studie u pacientů s transversální míšní lézí, kde se zatím testovaly pouze nekultivované autologní buňky kostní dřeně bez nosiče a dalších faktorů. Výsledky získané ve spolupráci týmu prof. E. Sykové a dr. P. Kobylky z ÚHKT, s doc. M. Bojarem a s pracovníky několika klinik ve FN Motol, byly publikovány v časopise Cell transplantation (2006). Studie prokázala bezpečnost této terapie, kdy a jakou cestou lze buňky využít, a je proto slibným začátkem pro další klinickou studii.
Syntetické hydrogely se v oblasti biomateriálů uplatňují téměř půlstoletí. Díky dlouhodobému ověření jejich kompatibility s živým organizmem (kontaktní a nitrooční čočky aj.) se stávají i v dnešním vývoji a výzkumu materiály první volby pro nové aplikace. Přitom lze výběrem jejich vhodné chemické a fyzikální struktury relativně snadno nastavit potřebné výsledné vlastnosti, ať už botnací, mechanické, transportní nebo optické. V kontextu rozvoje biomateriálů a nanotechnologií se v ÚMCH studovala poměrně široká škála hydrogelových materiálů pro hojení ran, léčbu popálenin a rozsáhlých kožních defektů. V CBTTN hrají hydrogely a další polymery svým způsobem jedinečnou roli, protože většina následných kroků spojených s aplikací různých typů kultivovaných buněk se realizuje jejich prostřednictvím. Kolegové z ÚMCH připravují jako kultivační podložky porézní materiály s nastavitelnou hydrofilitou, velikostí pórů a možností inkorporace záporných nebo kladných nábojů do struktury polymeru. Připravili hydrolyticky degradovatelné polymery s nastavitelnou dobou rozpadu. Kromě porézních struktur se v poslední době vědci v rámci CBTTN zabývají i využitím nanovlákenných struktur pro přípravu tkáňových konstruktů vzniklých prorůstáním buněk nanovlákennou matricí. V ÚMCH se připravovují vhodné polymerní roztoky, které je možné ve spolupráci s kolegy z TU Liberec a s firmou Elmarco zvláknit technologií elektrospinningu (přístrojem NanospiderTM) na nanovlákna s vhodnými vlastnostmi. Charakterizaci připravených hydrogelových a nanovlákenných vzorků a testování jejich biomedicinálních vlastností provádí tým prof. E. Sykové. Vzhledem k získaným výsledkům byla začátkem roku 2007 podána přihláška vynálezu (PV2007-54: Lesný P., Syková E., Michálek J., Přádný M., Jirsák O., Martinová L.: Biomateriál na bázi nanovlákenných vrstev a způsob jeho přípravy). V ÚMCH se rovněž podařilo vyvinout unikátní technologii nanášení monomolekulárních vrstev bílkovin, kterou je možné zavést i do porézních struktur tak, že jsou pokryty pouze přepážky mezi póry bez zanesení vlastních pórů. To umožní lepší růst kmenových buněk na těchto materiálech pro implantace 3D struktur.
Pracovníci v Centru se též dlouhodobě věnují výzkumu náhrady kožních defektů traumatického původu (popáleniny, omrzliny) či vzniklých metabolicky (bércový vřed, proleženina, diabetická noha). Jedním z možných způsobů jejich terapie je aplikace kultivovaných kožních buněk do místa defektu, ale dnes rutinně používaný způsob (souvislý porost na textilní podložce) je metodicky složitý a poskytuje velmi nestandardní výsledky. Skupina prof. K. Smetany proto připravila nový způsob transplantace kultivovaných kožních buněk-keratinocytů na polymerních nosičích ve spolupráci s ÚMCH. Tato léčba však není vhodná pro léčbu diabetické nohy, a proto vědci z ÚEM společně s diabetology a hematology z IKEM připravují další klinickou zkoušku využívající kmenové buňky kostní dřeně pro krytí a hojení kožních defektů u diabetické nohy.
Diabetes melittus je onemocnění, které je provázeno závažnými pozdními komplikacemi a dosavadní způsoby léčby jim nedokážou předejít. Již v dnešní době je možné nahradit chybějící inzulínovou sekreci transplantací Langerhansových ostrůvků, jež jsou izolovány ze slinivky břišní zemřelého člověka. Ve spolupráci s CBTTN se v IKEM tento způsob léčby provádí od roku 2005, zatím u pacientů se zvláště obtížným průběhem diabetu 1. typu s nebezpečnými poklesy hladin krevního cukru při inzulínové léčbě. Nevýhodami této metody jsou jak nutnost trvale podávat imunosupresivní léčbu, tak zejména nedostatek vhodných orgánů od zemřelých dárců. Nadějné se ale zdají postupy založené na přípravě inzulín produkujících linií odvozených z lidských kmenových buněk nebo přímo z buněk Langerhansových ostrůvků. V CBTTN proto doc. F. Saudek studuje možnost množení a diferenciaci kmenových buněk. Nově vznikající buňky jsou v laboratorních podmínkách schopné tvořit mikroorgány připomínající Langerhansovy ostrůvky, které vytvářejí inzulín.
Využití kmenových buněk a tkáňových náhrad v regenerativní medicíně lze v příštích letech důvodně předpokládat. Výzkum v CBTTN je proto nejen důležitou součástí základního i aplikovaného výzkumu, ale také předpokladem pro zavedení tzv. moderních metod do české klinické praxe.
EVA SYKOVÁ,
vedoucí Centra buněčné terapie a tkáňových náhrad


 English
English