Rezistence bakteriálních patogenů vyžaduje vyhledávání nových typů antimikrobiálních látek, které zabíjejí bakterie na základě principiálně odlišného mechanismu působení než tradiční antibiotika, a přitom nevytváří rezistenci. Mezi tyto látky patří antimikrobiální peptidy (AMP), které ačkoli ještě nebyly uvedeny do praxe, představují jednu z možných kategorií hledaných protiinfekčních látek. Výzkumem AMP se od roku 2007 zabývá jeden z vědeckých týmů v Ústavu organické chemie a biochemie AV ČR.
Sir Alexander Fleming uvádí objev penicilinu v článku publikovaném v British Journal of Experimental Pathology (1929) následujícími řádky: „Po dobu práce se stafylokoky bylo několik kultivačních ploten odloženo na stranu laboratorního stolu a čas od času prohlédnuto. Během zkoumání se plotny musely odkrýt, čímž došlo k jejich kontaminaci různými mikroorganismy. Kolem velké kolonie kontaminující plísně byly kolonie stafylokoků transparentní a očividně lyzované.“ [Původní anglická citace – “While working with staphylococcus variants a number of culture-plates were set aside on the laboratory bench and examined from time to time. In the examinations these plates were necessarily exposed to the air and they became contaminated with various micro-organisms. It was noticed that around a large colony of a contaminating mould the staphylococcus colonies became transparent and were obviously undergoing lysis.”].
Podle Flemingových slov se tento náhodný objev stal v pátek ráno 28. září 1928, čímž bylo zahájeno moderní období objevů antibiotik. Zlatý věk antibiotik následující po druhé světové válce až do sedmdesátých let minulého století znamená objevy téměř všech dnes známých typů antibiotik včetně jejich derivátů; v té době se zdá, že jsou bakteriální infekce navždy pod kontrolou. Nadměrné a nesprávné používání antibiotik si však krátce na to vybírá svou daň v podobě rezistence bakterií. Příkladem je Staphylococcus aureus rezistentní na methicillin (MRSA), Pseudomonas aeruginosa, Acinetobacter baumannii, rezistentní kmeny E. coli, ESBL produkující Klebsiella, infekce způsobené enterokoky či rezistentní formy tuberkulózy. Velmi alarmující je ovšem výskyt kmenů S. aureus, které vykazují rezistenci k vancomycinu; vancomycin se stále považuje za antibiotikum poslední volby proti S. aureu a jiným odolným bakteriím – ovšem ne na dlouho. Vstup nových antibiotik od jejich objevu v laboratoři do klinické praxe je však stále pomalejší a nedrží krok s rychlostí, s jakou bakterie získávají proti antibiotikům rezistenci. Možnost objevovat nová antibiotika je stále menší, neboť jejich výzkum není pro farmaceutické firmy rentabilní. Slovy mnoha odborníků se velmi rychle blížíme do doby „postantibiotické“.
Vzhledem k této situaci byl již před lety, a to převážně v akademických institucích, zahájen výzkum nových alternativních antimikrobiálních látek včetně antimikrobiálních peptidů. Jde o peptidy složené z 10 až 50 aminokyselin, které kvůli svému určitému aminokyselinovému složení mají schopnost vytvářet specifické konformace nutné pro antimikrobiální aktivitu. Většinou jde o kationické molekuly, a to díky přítomnosti kladně nabitých aminokyselin lysinu a argininu v jejich sekvenci. AMP jsou součástí vrozeného imunitního systému prakticky všech živých organismů, vykazují antimikrobiální aktivity srovnatelné s konvenčními antibiotiky, ale zabíjejí bakterie podstatně rychleji. I když mechanismus zabíjení bakterií AMP není dostatečně probádán, obecně se přijímá, že tyto kladně nabité peptidy jsou přitahovány k negativně nabitému povrchu bakteriální membrány, interagují s ní, proniknou do její lipidové dvouvrstvy a různými mechanismy naruší její strukturu, v důsledku čehož unikne cytoplazmatický obsah a nastane smrt bakterie (obr. 1).
Všechna fota: Archiv autora
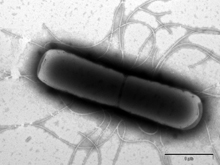
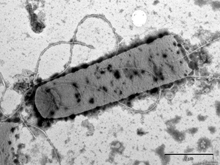
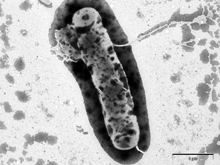
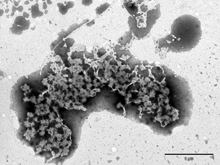
Obr. 1
Zabíječský účinek antimikrobiálního peptidu lucifensinu na Gram-pozitivní bakterii Bacillus subtilis sledovaný elektronovou mikroskopií. A) B. subtilis bez lucifensinu; B) po 10 minutách působení lucifensinu; C) a D) po 60 minutách působení
Některé AMP pronikají dále do nitra bakterií, kde naruší jejich metabolismus nebo poškodí cytoplazmatické komponenty. Jednoduše řečeno: AMP na rozdíl od tradičních antibiotik zabíjejí bakterie „z vnějšku“ a rychle, proti čemuž si bakterie nejsou schopny vytvořit rezistenci. Odlišné složení membrán eukaryotických buněk složené z fosfolipidů převážně neutrálního charakteru a cholesterolu brání tyto živočišné buňky před účinkem AMP.
Antimikrobiální peptidy se kategorizují na základě sekundární struktury. Nejpočetnější a také nejvíce studovanou kategorii kationických peptidů představují lineární α-helikální peptidy. Obvykle obsahují 10–40 aminokyselin, z nichž jsou výrazně zastoupeny hydrofobní aminokyseliny. Ve vodném prostředí mají neuspořádanou strukturu, ale při kontaktu s bakteriální membránou „foldují“ do vysoce uspořádaného stavu amfipatického helixu (šroubovice), v němž postranní řetězce hydrofobních aminokyselin vyčnívají na jednu stranu helixu, zatímco postranní řetězce hydrofilních aminokyselin včetně kladně nabitých aminokyselin argininů a lysinů čnějí na protilehlou stranu helixu (obr. 2).
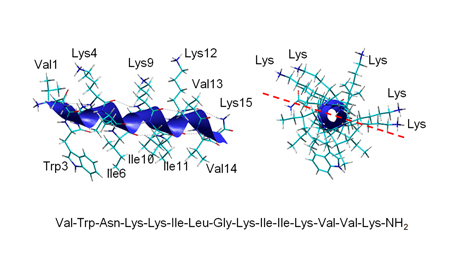
Obr. 2
Amfipatická α-helikální struktura antimikrobiálního peptidu lasioglossinu III izolovaného z jedu divoké, primitivně eusociální včely Lasioglossum laticeps. Boční pohled znázorňuje helikální strukturu. V kolmém pohledu ve směru osy je zřetelný amfipatický charakter peptidu, kdy postranní řetězce hydrofilních aminokyselin včetně pěti kladně nabitých lysinů vyčnívají na jednu stranu od pomyslné roviny a na opačnou stranu od roviny směřují do prostoru postranní řetězce hydrofobních aminokyselin. Sekvence peptidu v délce 15 aminokyselin je uvedena třípísmenkovým kódem.
Toto strukturní uspořádání je předpokladem pro jejich antimikrobiální účinek. Typickým zástupcem této skupiny je lidský cathelicidin označovaný jako LL-37, peptid složený z 37 aminokyselin a obsažený v neutrofilech, v zabíječských buňkách, v žirných buňkách a epiteliálních buňkách. Helikální strukturu má i kontroverzní magainin izolovaný z kůže žab, jehož syntetický analog Pexiganan jako první antimikrobiální peptid procházel klinickým testováním, ale bohužel nebyl nakonec pro klinické využití schválen. Do této kategorie patří i většina kratších AMP izolovaných z jedu žahadlového hmyzu (Hymenoptera) včetně AMP identifikovaných v Ústavu organické chemie a biochemie AV ČR v jedu divokých včel. Jde o katonické peptidy v délce 12–18 aminokyselin s poměrně velkým zastoupením Arg a Lys. Některé z těchto AMP vykazují značnou antimikrobiální aktivitu, ale nízkou, popřípadě jen mírnou toxicitu vůči eukaryotním buňkám a ve srovnání s peptidy podobných vlastností objevenými jinými vědeckými týmy vykazují vyšší antimikrobiální účinky. Kromě toho, tyto peptidy jsou také aktivní proti kvasinkám (Candida albicans) a lyzují některé rakovinné buňky.
Pro AMP se strukturou skládaného listu (β-sheet) je typická přítomnost několika těchto strukturních domén v molekule. Konformace těchto peptidů je stabilizovaná propojením pomocí disulfidových můstků. Přítomnost disulfidových můstků utvářejících cyklickou strukturu je pro většinu těchto peptidů nutná pro udržení antimikrobiální aktivity a zároveň zvyšuje jejich odolnost proti proteolytickým enzymům. Význačnými zástupci této kategorie jsou lidské defensiny obsahující tři skládané listy svázané pospolu a zároveň se zbytkem molekuly třemi disulfidovými můstky (obr. 3).
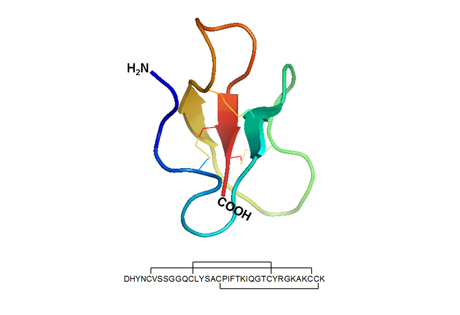
Obr. 3
Prostorová struktura a sekvence lidského β-defensinu 1 (hBD-1). Pro tuto molekulu je dominantní přítomnost tří skládaných listů (antiparallel β-sheets). Molekula je stabilizována pomocí tří disulfidových můstků. Primární struktura peptidu v délce 36 aminokyselin uvedená jednopísmenovým kódem znázorňuje vzájemné propojení šesti cysteinů v pořadí 1–5, 2–4 a 3–6.
Na základě odlišného propojení disulfidových můstků se tyto peptidy dělí na α-defensiny a β-defensiny. α-defensiny jsou aktivní proti mnohým Gram-pozitivním i Gram-negativním bakteriím, některým virům a plísním a jsou složeny z 29–35 aminokyselin. Čtyři z těchto defensinů označované jako Human Neutrophil Peptides (HNP-1,-2,-3 a -4) jsou produkované neutrophily. Další dva defensiny, HD-5 a HD-6 (Human Defensins 5 a 6), byly nalezeny v Panethových buňkách tenkého střeva.
β-defensiny (hBD) mají podstatně odlišné aminokyselinové složení než α-defensiny a jsou to poněkud větší molekuly. Kvůli třem disulfidovým můstkům mají s α-defensiny velmi podobnou terciární strukturu (prostorové uspořádání). Jsou produkovány převážně v buňkách kůže, například v keratinocytech, sebocytech či potních žlázách, kde byly identifikovány čtyři hBD. Při povrchových zraněních vykazují široké spektrum antibakteriální, antivirové a antifungální aktivity. Defensiny se účastní dalších imunitních procesů při hojení ran, a to tím, že stimulují produkci cytokinů a chemokinů a migraci keratinocytů a jejich proliferaci.
Na rozdíl od lidských defensinů některé defensiny izolované z hmyzu obsahují ve své molekule jak α-helix, tak i β-sheet. Tato struktura je typická pro defensiny z hmyzu řádu diptera. Lucifensin – defensin imunitního systému medicinálních larev mouchy Lucilia sericata – je typickým příkladem struktury obsahující „cysteine-stabilized αβ motif“, kde je α-helix propojen s antiparalelní β-strukturou pomocí dvou disulfidových můstků. Další disulfidový můstek přichytává N-koncovou smyčku k jednomu z β-sheetu (obr. 4).
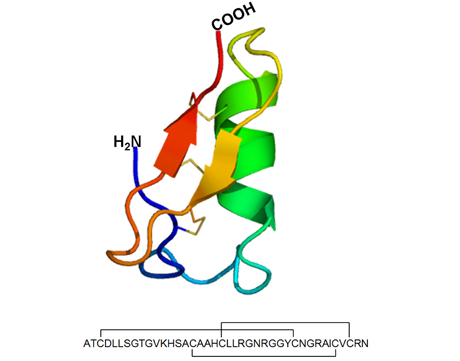
Obr. 4
Prostorová struktura a sekvence lucifensinu. Tento hmyzí defensin složený ze 40 aminokyselin obsahuje jako dominantní strukturní prvky α-helix a antiparallel β-sheet. Tyto strukturní prvky jsou mezi sebou odděleny smyčkami a vzájemně propojeny disulfidovými můstky v pořadí 1–4, 2–5 a 3–6.
Lucifensin je vylučován larvami mouchy bzučivky zelené (Lucilia sericata) do infikované rány během léčebné procedury známé jako larvální terapie, využívané především k léčení syndromu diabetické nohy. Během procesu larvy pomocí svých trávicích enzymů odstraní infikovanou nekrotickou tkáň. Lucifensin přispívá k ochraně larev před infekcí a zároveň zabíjí bakterie uvnitř rány a dezinfikuje ji. Počátky cíleného použití larvální terapie se datují od konce první světové války. Můžeme tedy považovat nasazení larev do rány za první praktické, ale nevědomé použití antimikrobiálního peptidu lucifensinu k léčebným účelům?
Identifikovat antimikrobiální působky vylučované medicinálními larvami do rány se vědci snažili již od třicátých let minulého století. Od té doby bylo identifikováno pouze několik nízkomolekulárních organických látek (např. fenylacetaldehyd, fenyloctová kyselina a kyselina p-hydroxybenzoová) s bakteriostatickým účinkem. Je však s podivem, že teprve v první dekádě tohoto století se začalo intenzivně pátrat po antimikrobiálních peptidech produkovaných imunitním systémem těchto larev. Onen hledaný antimikrobiální peptid se prvně podařilo z larev mouchy Lucila sericata izolovat v laboratoři v ÚOCHB AV ČR ve spolupráci s lékaři Institutu klinické a experimentální medicíny, a poté co byla určena jeho primární sekvence, byl pojmenován lucifensin. Lucifensin jako jediný AMP doposud identifikovaný v medicinálních larvách má baktericidní účinek proti Gram-pozitivním bakteriím infikujícím ránu (S. aureus), ale je bohužel neúčinný proti Gram-negativním bakteriím. To vysvětluje selhání larvální terapie při léčení ran infikovaných Gram-negativní bakterií Pseudomonas aeruginosa.
Lineární peptidy s rozvinutou strukturou se vyznačují nadměrným obsahem jedné či více aminokyselin v sekvenci, která nevytváří žádnou z výše uvedených sekundárních struktur. Například histatin obsažený v lidských slinách je bohatý na histidin, indolicidin izolovaný z hovězích neutrofilů obsahuje v sekvenci třinácti aminokyselin pět tryptofanů a tři proliny. Pyrrhocoricin z hemolymfy ploštice patří do skupiny klasifikované jako „proline-arginine rich peptides“, podobně jako apidaecin ze včely medonosné či drosocin z mouchy Drosophila melanogaster. Některé Pro-Arg rich AMP mohou kvůli vysokému obsahu prolinu zaujmout prostorovou strukturu známou jako polyprolin II helix.
Jaké jsou předpoklady a možnosti využití AMP v praxi? Měly by mít široké spektrum aktivity, selektivní toxicitu vůči mikrobům, minimální vedlejší účinky a minimální riziko bakteriální rezistence, tedy vlastnosti odpovídající jejich přirozené funkci. Všeobecně známý problém stability peptidů vyplývající z jejich citlivosti vůči proteolytickému štěpení může být překonán syntézou vhodně navrženého analoga. Principiální překážkou se ale zdá výrobní cena, která může být mnohonásobně vyšší než výrobní cena tradičních antibiotik. Proto se farmaceutické firmy orientují spíše na komercionalizaci kratších AMP, jako byl již zmíněný Pexiganan (22 aminokyselin), nebo analoga indolicidinu (13 aminokyselin) či histatinu (12 aminokyselin). Velmi nadějně vypadá komercionalizace peptidu LTX-109 oznámená letos norskou firmou Lytix Biopharma. Jde o peptidovou sloučeninu, jejíž základ tvoři překvapivě pouze tři aminokyseliny (Trp a dva Arg).
VÁCLAV ČEŘOVSKÝ,
Ústav organické chemie a biochemie AV ČR, v. v. i.


 English
English