O roli extracelulárních enzymů v koloběhu živin se vědělo poměrně dlouho, ale jejich studium ve vodním prostředí nebylo zpočátku snadné. Teprve nabídka umělých kolorigenních a fluorigenních substrátů znamenala významný metodický impuls pro studium enzymatických aktivit ve vodních ekosystémech. Postupně se konstituovaly dva hlavní směry výzkumu extracelulárních enzymů v limnologii: jednak výzkum extracelulárních glykolytických a proteolytických enzymů a jejich úlohy v mikrobiálním rozkladu organické hmoty (biogeochemický cyklus uhlíku), jednak studium extracelulárních fosfatáz, především jejich role při limitaci fytoplanktonu fosforem (cyklus fosforu).
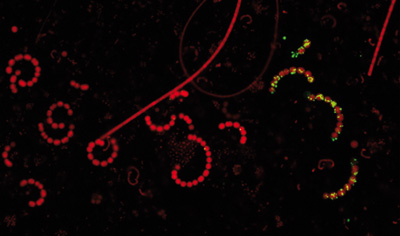
Typický zástupce fytoplanktonu eutrofní nádrže Římov, sinice Anabaena sp. (korálkovité kolonie) – i přes relativní nedostatek fosforu v letním období najdeme v populaci jak neaktivní (červené řetízky v levé části snímku), tak aktivní buňky, resp. vlákna (extracelulární fosfatázy zviditelňuje zelená fluorescence).
Foto: Archiv autora
Hlavní ekologický význam fosfatáz spočívá ve zpřístupnění fosforečnanů vázaných esterickými vazbami na různé organické sloučeniny, především nukleotidy a fosforylované sacharidy. Protože osmotrofní mikroorganismy mohou přijímat fosfor pouze ve formě ortofosforečnanu, bývá právě produkce extracelulárních fosfatáz považována za adaptační mechanismus mikroorganismů na jeho nedostatek v prostředí. Zatímco kyselé fosfatázy se považují za konstitutivní enzymy, produkované především bakteriemi, alkalické fosfatázy se považují za adaptivní ektoenzymy, indukované nedostatkem fosforu, a to zejména u fyto-planktonu. Nedostatek anorganického fosforu je běžný ve stojatých vodách, zejména v epilimniu teplotně stratifikovaných nádrží, neboť fosfor je živinou začasto limitující produktivitu většiny povrchových vod. Z uvedených důvodů se alkalické fosfatázy považují za vhodný indikátor limitace fytoplanktonu fosforem, zatímco výsledky jiných studií jejich indikační hodnotu zpochybňují. Vyřešit uspokojivě tento rozpor nebylo donedávna možné, protože hlavní nevýhodou dosud používaných substrátů bylo stanovení pouze úhrnné aktivity všech enzymů v daném vzorku vody s velmi omezenými možnostmi nepřímého odlišení různých producentů (zdrojů aktivity).
Vyrovnat se s tímto nedostatkem umožnilo až zavedení nové generace fluorigenních substrátů (na bázi 2-(2-fosforyloxyfenyl)-4-(3H)-chinazolinonu; ELF®97), jejichž produktem je (za vhodných podmínek) vznik nerozpustné sraženiny v místě hydrolýzy, což dovoluje přímo lokalizovat pozici aktivního enzymu v organismech (buňkách) pomocí epifluorescenční mikroskopie. První aplikace komerčních fosfatázových kitů k detekci tzv. adaptivních fosfatáz u fytoplanktonu vyvolaly řadu metodických pochybností, způsobených zřejmě lpěním na původních histologických postupech.
Protože v HBÚ mělo studium fosfatáz v silně fosforem limitovaných vodách dlouholetou tradici, s chutí jsme se v r. 2000 pustili do aplikace horké novinky, na niž jsme časem získali projekty GA AV: Detekce, lokalizace a kvantifikace extracelulárních enzymatických aktivit na buněčné a populační úrovni v přirozeném sestonu stojatých vod (A6017202, 2002–2005) a Studium regulace aktivity extracelulárních fosfatáz u různých morfotypů přirozeného bakterioplanktonu na úrovni jednotlivých buněk (A600170602, 2006–2008).
Metodické potíže vyřešilo přímé použití ELF®97 fosfátu (ELFP) podle osvědčeného protokolu na fluorescenční stanovení extracelulární aktivity planktonu a jeho další standardizace – předfixace HgCl2 a pufrace vzorků. Paralelní inhibiční pokusy prokázaly, že oba substráty (ELFP i běžný MUF fosfát) jsou nepochybně hydrolyzovány stejnými extracelulárními fosfatázami. Tento protokol umožňuje nejen rozlišení enzymaticky aktivních a neaktivních jedinců ve vzorku, ale i kvantifikaci enzymatické aktivity na buněčné nebo druhové úrovni pomocí počítačové analýzy obrazu.
Po inkubaci vzorku s ELFP se zachytí drobné planktonní organismy (bakterie, sinice, řasy, prvoci, vířníci aj.) na membránovém filtru, na němž lze v epifluorescenčním mikroskopu rozlišit jednotlivé organismy a místa fosfatázové aktivity. Produkt hydrolýzy – nerozpustná sraženina ELF alkoholu – se hromadí v okolí enzymu (např. na povrchu řasové buňky, v žaludku vířníka apod.), kde vytváří často charakteristické struktury (viz fotografie), a při excitaci dlouhovlnným UV zářením emituje žlutozelenou fluorescenci, jejíž intenzita je úměrná aktivitě daného enzymu. Intenzitu fluorescence jednotlivých mikroskopických objektů můžeme změřit pomocí analýzy obrazu (používáme český software Lucia, resp. NIS Elements – jehož mikrobiologické aplikace vyvíjí firma Laboratory Imaging v úzké spolupráci s naším pracovištěm). Pro metodu jsme navrhli akronym FLEA (Fluorescently Labelled Enzyme Activity), protože původní označení – ELF (Enzyme Labelled Fluorescence) technika (v histologii, též obchodní značka pro substráty) – bylo jako zavádějící předmětem kritiky recenzentů.
Ideální využití zatím metoda FLEA našla především v ekologii fytoplanktonu, protože sinice a řasy můžeme dobře rozlišit v epifluorescenčním mikroskopu – kromě často druhově charakteristického značení fosfatáz (zelené fluorescence) – pomocí charakteristické červené autofluorescence chlorofylu, resp. typického tvaru buněk sinic, uspořádání kolonií či tvaru a umístění chloroplastů u různých druhů řas. Díky tomu bylo již na první pohled zřejmé, že ve fytoplanktonu se vyskytují jak druhy s aktivními extracelulárními fosfatázami, tak druhy neaktivní, a to často bez ohledu na aktuální (ne)dostatek fosforu v okolní vodě. Ještě překvapivější pro nás byl nález značených i neznačených buněk v rámci téže populace; později jsme zjistili, že specifická aktivita fosfatáz u některých druhů řas vykazuje výrazné krátkodobé změny, zřejmě v závislosti na fázi buněčného cyklu. Po neúspěšných pokusech studovat extracelulární fosfatázy v experimentálních řasových kulturách jsme zvolili „oportunní strategii“ výzkumu přirozeného fyto-planktonu limitovaného fosforem – při troše štěstí můžeme natrefit na krátká období, během nichž jsou druhy produkující fosfatázy hojně zastoupeny ve fytoplanktonu, resp. jejich buňky jsou dobře odlišitelné. Právě u takových druhů pak můžeme dobře měřit individuální buněčné aktivity a studovat roli extracelulárních fosfatáz v konkurenci o fosfor.
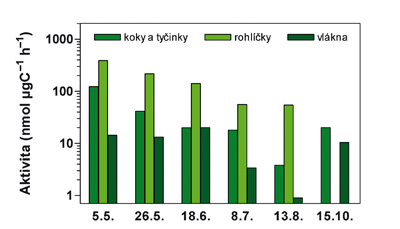
Čertovo jezero – sezónní vývoj specifické aktivity extracelulárních fosfatáz vztažené na biomasu charakteristických bakteriálních morfotypů (logaritmická stupnice umožňuje lépe porovnat řádové rozdíly aktivity na jednotku biomasy v mg uhlíku).
Foto: Archiv autora
Z tohoto hlediska jsou ideálními pokusnými vodami šumavská jezera, jejichž plankton má celoročně deficit fosforu. Navíc v biomase planktonu v těchto letech dominují (v důsledku acidifikace a neobvykle vysokých koncentrací hliníku) mikroorganismy – tj. řasy, sinice, a zejména vláknité bakterie. Díky těmto unikátním okolnostem můžeme studovat krátkodobé (diurnální) i dlouhodobé (sezónní) změny fosfatázové aktivity u populací jednotlivých druhů řas a také u různých bakteriálních morfotypů (viz grafy). Změny aktivity jednotlivých buněk či celých populací zjevně souvisí s jejich aktuální potřebou fosforu, resp. s růstem populací.
Úspěšnou aplikací metody FLEA byla též detekce trávicích enzymů a měření individuální aktivity fosfatáz u vířníků. Podařilo se např. experimentálně ověřit, že na různou potravní nabídku (různé množství řasové kultury s různým obsahem fosforu) vířníci reagují regulací enzymatické aktivity v trávicím traktu.
Jaroslav Vrba,
Biologické centrum AV ČR, v. v. i., Hydrobiologický ústav a Přírodovědecká fakulta Jihočeské univerzity v Českých Budějovicích


 English
English