Nebezpečným, ale mezi studenty oblíbeným pokusem demonstrujícím explozivní chemickou reakci je vhodit kousek kovového sodíku do vody. Každý učitel chemie ví, že výbuch nastává kvůli uvolňování tepla při přechodu elektronů z kovu do vody, přičemž vzniká pára, hydroxid a vodík, který se může vznítit. Plyny vznikající na rozhraní mezi kovem a vodou by ale měly od sebe tyto reaktanty oddělit a tím reakci potlačit. Jak to, že k výbuchu přesto dochází? Pomocí záběrů ultrarychlé kamery a molekulových simulací se podařilo odhalit dosud neznámý primární mechanismus explozivní reakce alkalických kovů ve vodě. Poté, co elektrony přejdou z alkalického kovu do vody, vytvoří se na jeho povrchu značně veliký kladný náboj. Kvůli vzájemnému odpuzování těchto nábojů dojde k takzvané coulombické explozi, kdy s povrchu ohromnou rychlostí vylétají kousky kovu do vody. Tím se reaktanty efektivně promíchají, což je podmínkou výbuchu.
Vysvětlení tohoto spektakulárního jevu lze najít také v učebnicích. Sodík se jako neušlechtilý kov vyznačuje malou výstupní prací, jeho valenční elektrony proto ochotně přecházejí z kovu do vody. S ní bouřlivě reagují za vzniku hydroxidových aniontů a vodíku. Celý proces je silně exotermní. Kvůli uvolněnému teplu exploduje pára a za přítomnosti kyslíku se vznítí produkovaný vodík, který může mít také výbušný charakter.

Všechna fota: Archiv autora
Obr. 1 – Experimentální zařízení ke studiu explozí alkalických kovů ve vodě, jak bylo realizováno na Technické univerzitě v Braunschweigu. Vlevo s ochranným štítem Phil Mason a Sigurd Bauerecker (který byl natolik statečný, že si nás pustil do své dobře vybavené laboratoře).
Výše uvedené vysvětlení má ale jeden háček; aby mohl výbuch nastat, musí být reaktanty dobře promíchány – vzpomeňme na střelný prach, kde jsou dokonale smíchány jemné částice ledku, dřevěného uhlí a síry. Reakce sodíku ve vodě ale vypadá jako silně heterogenní proces mezi dvěma makroskopickými reaktanty, alkalickým kovem a vodným roztokem. Navíc se na makroskopickém rozhraní mezi reaktanty, kde jedině může reakce probíhat, vyvíjí vodík a vodní pára. Tyto plyny by měly reaktanty od sebe efektivně oddělit, čímž by se měla reakce zastavit. Jak je tedy možné, že k výbuchu vůbec může dojít?
Odpověď na výše uvedenou otázku jsme se pokusili najít pomocí (jen mírně nebezpečných) pokusů s použitím ultrarychlé kamery, jakož i (naprosto bezpečných) simulací molekulové dynamiky s použitím metod funkcionálu hustoty i empirických potenciálů. V následujících částech popíšeme experimentální i výpočetní metodiku a podělíme se o získané výsledky a jejich diskusi.
Experimenty s ultrarychlou kamerou
Čtenář si možná vzpomene, že učiteli chemie se ve školním experimentu se sodíkem někdy výbuch podařil a jindy ne. Proces reakce sodíku s vodou je značně eratický, kov někdy exploduje prakticky okamžitě, jindy až po chvíli bouřlivé reakce na vodním povrchu a občas k výbuchu vůbec nedojde. Vše závisí na velikosti a čistotě povrchu kovu, teplotě, výšce, ze které kov dopadá na hladinu, a dalších faktorech. Výsledky takových studií je snad možné publikovat v Journal of Irreproducible Research, ale do solidního vědeckého časopisu se nehodí.
Na základě stovek předběžných pokusů, které prakticky bez úrazu prováděl ve volném čase člen naší výzkumné skupiny Phil Mason buď v plenéru, nebo na balkoně našeho pracoviště (k nelibosti kolegů, kteří tam popíjeli kávu) se podařilo vytvořit plně reprodukovatelný experimentální protokol pro studium explozí alkalických kovů ve vodě. Protokol lze shrnout do tří hesel: slitina sodíku a draslíku; argonová ochranná atmosféra; ultrarychlá kamera. Zatímco sodík i draslík jsou za pokojové teploty kovy v pevném skupenství, jejich slitiny jsou v širokém rozsahu relativních koncentrací kapalné. To umožňuje snadnější manipulaci a přesnější dávkování pomocí jednoduché stříkačky. Navíc prakticky odpadají problémy s povrchovými nečistotami, zvláště pokud celá manipulace a experimentování probíhá pod argonem. Nepřítomnost kyslíku při experimentech navíc zabraňuje vznícení produkovaného vodíku, což výrazně snižuje ničivé účinky výbuchů. Vlastní exploze alkalického kovu ve vodě trvá velice krátce; jeden okamžik a je po všem. Ke kvalitnímu zachycení celého procesu je proto třeba výkonná ultrarychlá kamera s časovým rozlišením alespoň 10 000 snímků za sekundu. Ta není levná, může stát kolem milionu korun. Naštěstí si ji lze za zlomek ceny na pár dní od výrobce půjčit (pokud ovšem jen mlhavě naznačíte, k čemu ji budete potřebovat). Experimentální zařízení znázorňuje obr. 1. V popředí je kamera firmy Imaging Solutions schopná zachytit až 30 000 snímků za sekundu; za ní je experimentální zařízení, v němž kapka slitiny sodíku a draslíku o hmotnosti okolo 100 mg po vypuštění ze stříkačky padá metrovou skleněnou trubicí naplněnou argonem do vody, aby vzápětí explodovala.
Obr. 2 zachycuje řadu snímků pořízených ultrarychlou kamerou. V levém sloupci jsou snímky z výbuchu kapky slitiny sodíku a draslíku s kamerou umístěnou nad hladinou vody, zatímco obrázky v pravém sloupci byly pořízeny s kamerou filmující přes sklo pod hladinou. V obou případech je vidět, jak zhruba 0,2–0,3 m/s po kontaktu s vodní hladinou začínají z kapky vystřelovat do vody jehličky kovu. Důležité je si uvědomit, že proces „proměny kuličky na ježka“ se děje před vlastním výbuchem vyvíjené páry a vodíku (viz spodní dva snímky vpravo). Dále to lze demonstrovat na analogickém pokusu v kapalném amoniaku, kdy exploze nenastává. Přesto i tam lze pozorovat (byť s poněkud horším rozlišením) vytváření kovových jehliček na povrchu kapky při kontaktu s amoniakem, viz obr. 2.
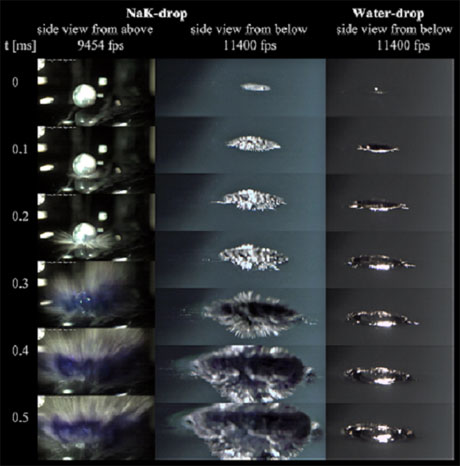
Obr. 2 – Snímky z filmů pořízených ultrarychlou kamerou (kolem 10 000 snímků za sekundu) zachycující dopad kapky slitiny sodíku a draslíku do vody. Vlevo byla kamera nad a uprostřed pod úrovní vodní hladiny (vpravo jsou pro srovnání snímky dopadající vodní kapky).
Nakonec si všimněme modré „skvrny“, která se objevuje na obr. 3 na snímcích od 0,3 m/s. Postupně se daří získat nezvratný spektroskopický důkaz, že jde o jev způsobený světelnou absorpcí hydratovaných elektronů v červené oblasti viditelného spektra. Modrá barva spojená se solvatací elektronů při vhození sodíku do kapalného amoniaku byla pozorována už v 19. století a správně interpretována začátkem století dvacátého. V situaci zachycené na obr. 3 je absorpce elektronů natolik silná, že modrá barva na povrchu kapky přechází až do černé. Zatímco v kapalném amoniaku žijí elektrony minuty až hodiny, jejich život ve vodě je díky silné reaktivitě zkrácen na mikrosekundy až milisekundy. Obr. 2 tak zřejmě představuje celkem unikátní „okometrické“ zachycení solvatovaných elektronů ve vodě.
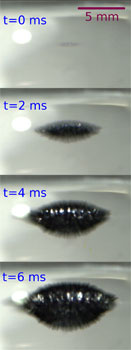
Obr. 3 – Snímky z ultrarychlé kamery zachycující kontrolní experiment, při kterém kapka slitiny sodíku a draslíku dopadá místo do vody do kapalného amoniaku.
Simulace molekulové dynamiky
Abychom blíže objasnili fyzikální původ kovových jehliček vystřelujících z kapky alkalického kovu do vody a zachycených ultrarychlou kamerou, rozhodli jsme se provést molekulové simulace (ostatně jde o práci, kterou děláme v normální pracovní době). Protože při studovaném procesu dochází k přenosu elektronů z alkalického kovu do vody a k následnému štěpení chemických vazeb, nelze přímočaře použít metodu molekulové dynamiky s empirickým potenciálem (MDEP), kdy jsou vazebné poměry jednou pro vždy zafixovány. Místo toho jsme použili nejprve metodu ab initio molekulové dynamiky (AIMD), kdy se energie a síly počítají pomocí metod funkcionálu hustoty, jež umožňuje přímé studium chemických přeměn. Problém je, že metoda AIMD je výpočetně o mnoho řádů náročnější než MDEP. Mohli jsme si tak dovolit simulovat po dobu několika pikosekund jen velmi malý modelový systém, skládající se z 19 atomů sodíku obklopených 174 molekulami H2O. Přesto však dovolil studovat chemické přeměny spojené s přechodem elektronů ze sodíků do vody (viz níže) a navíc nám AIMD simulace umožnily vytvořit parametrizaci pro MDEP simulaci mnohem většího systému. Konkrétně jsme vytvořili empirický potenciál, ve kterém se během simulace neutrální atomy sodíku automaticky mění v sodné kationty, jakmile se dostanou do kontaktu s molekulami vody. Zároveň se příslušný počet molekul vody přemění v hydroxidové anionty. Takto jsme po dobu 10 pikosekund simulovali celý proces pro klastr, jenž na počátku sestával ze 4000 atomů sodíku obklopených více než 34 000 molekulami vody.
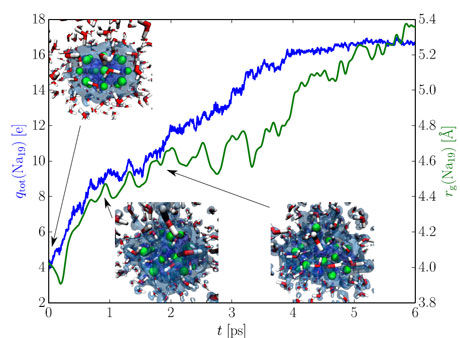
Obr. 4 – Výsledky simulací ab initio molekulové dynamiky. Zelená křivka zachycuje časový vývoj velikosti (tj. gyračního poloměru rg) sodíkového klastru, zatímco modrá křivka ukazuje počet elektronů (qtot), které přešly ze sodíků do vody. Na „snímcích“ ze simulace jsou sodíky vyznačeny zeleně, kyslíky červeně, vodíky bíle a (původně) valenční elektrony sodíků modře.
Na obr. 4 jsou shrnuty výsledky AIMD simulací. Je vidět, že při kontaktu s vodou přecházejí valenční elektrony sodíků do vody a celý sodíkový klastr přitom expanduje. Zároveň také dochází k chemické reakci, při níž elektrony reagují s molekulami vody za tvorby hydroxidových iontů a molekulárního vodíku. Proces je pro tak malý systém velmi rychlý a odehrává se na časové škále jednotek pikosekund. Jde o cenná data, bohužel, jak již bylo řečeno, je ale systém příliš malý, aby mohl poskytnout informaci o mechanismu vytváření kovových jehliček při kontaktu alkalického kovu s vodou, jak jsme pozorovali při výše popsaných pokusech.
Abychom se přiblížili k experimentu, provedli jsme simulace pro mnohem větší systém pomocí metody MDEP (viz obr. 5). Snímky ze simulace v horní části obrázku ukazují, že systém je nyní už dostatečně velký, aby se při expanzi sodíkového klastru objevily „jehličky“ sodíku pronikající do vodného prostředí. Jde tak o mikroskopickou analogii procesu, který jsme předtím pozorovali v makroskopickém experimentu. Křivky na obr. 5, zachycující vývoj velikosti sodíkového klastru v čase, ukazují, že rychlost expanze závisí na vzdálenosti, v jaké jsou ve vodné fázi umísťovány hydroxidové anionty kompenzující náboj vznikajících sodných kationtů. Čím větší je separace mezi kationty a anionty, tím rychleji sodíkový klastr expanduje.
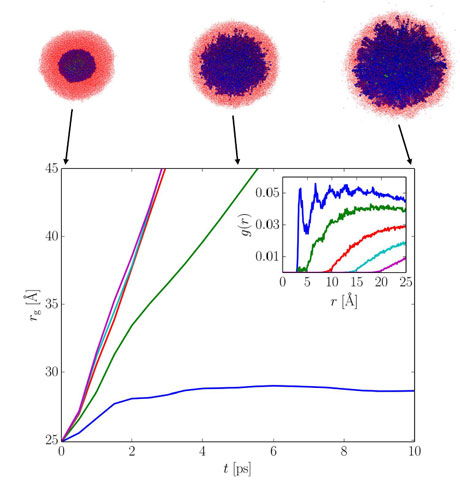
Obr. 5 – Výsledky simulací molekulové dynamiky s empirickým potenciálem. Křivky ukazují vývoj velikosti (tj. gyračního poloměru rg) sodíkového klastru v čase v závislosti na zvolené radiální distribuci g(r) vznikajících hydroxidových iontů (vnitřní obrázek). „Snímky“ ze simulace zachycují expanzi sodíkového klastru (modře) ve vodě (červeně).
Co jsme se vlastně dozvěděli nového o notoricky známé explozivní reakci alkalických kovů ve vodě? Odpověděli jsme na otázku z úvodu, proč alkalické kovy ve vodě explodují, když by vlastně neměly? Odpověď zní – ano – pomocí experimentů s ultrarychlou kamerou a simulací molekulové dynamiky. Záznamy z ultrarychlé kamery, zachycující explozi kapky slitiny sodíku a draslíku ve vodě, ukázaly, že před vlastní chemickou explozí z kapky vylétávají do vody kovové jehličky. Jaká je ale fyzikální podstata síly, která způsobuje vytváření těchto jehliček? Na tuto otázku odpověděly molekulové simulace spolu s jednoduchou fyzikální úvahou. V učebnicích se při vysvětlování studovaného procesu píše o přechodu elektronů z alkalického kovu do vody. Když se řekne „A“, musí se ale také říci „B“. A tím je skutečnost, že při masivním přechodu záporně nabitých elektronů do vody se kapka s neuvěřitelnou účinností kladně nabíjí. Do té míry, že coulombická repulze mezi těmito kladnými náboji překoná soudržnou sílu materiálu, charakterizovanou v tomto případě povrchovým napětím kapky. Jde tedy o novou „inkarnaci“ známého jevu coulombické exploze, při které z kapky vylétávají tzv. Rayleighovy jehličky. Coulombickou explozi předpověděl již v 19. století lord Rayleigh pro silně elektricky nabité vodní kapky a dnes se využívá např. v hmotové spektroskopii při metodě „electrospray“. Jednoduchý výpočet dokládá, že v našem případě ke coulombické explozi stačí, aby separace mezi kladnými a zápornými náboji byla větší než zhruba 0,5 nm, což skvěle souhlasí s výsledky MDEP simulací (obr. 5). Závěrem můžeme konstatovat, že nově odhalená coulombická exploze kapky slitiny sodíku a draslíku ve vodě zajišťuje efektivní promíchání reaktantů a umožňuje tak existenci následného chemického výbuchu vodíku a přehřáté páry.
Autor děkuje za podporu Grantové agentuře ČR (grant č. P208/12/G016) a AV ČR (Praemium Academie). Zároveň varuje, že pokusy s alkalickými kovy mohou být nebezpečné. Klíčem k dlouhému a zdravému životu experimentátora je maximální opatrnost. Při pokusech musí být nasazen ochranný obličejový štít a je třeba používat jen malé množství (ne více než okolo 0,1 g) alkalického kovu, ideálně v prostředí bez přítomnosti kyslíku (například pod argonem).
(Článek byl s úpravami přejat z příspěvku, který vyšel v Chemických listech – květen 2016.)
PAVEL JUNGWIRTH,
Ústav organické chemie a biochemie AV ČR, v. v. i.


 English
English