GABRIELA ADÁMKOVÁ
Podle časopisů Science a Nature se vědeckou metodou roku 2010 stala optogenetika. O badatelích, kteří ji vyvinuli, se dokonce hovoří jako o žhavých kandidátech na Nobelovu cenu. Letos poprvé s jejími principy seznámil během Týdne mozku českou veřejnost dr. Tomáš Hromádka z Oddělení neurofyziologie sluchu Ústavu experimentální medicíny AV ČR. Jak se pomocí této slibné metody odhaluje tajemství činnosti nervových buněk?

Všechna fota: Stanislava Kyselová, Akademický bulletin
Tomáš Hromádka vystudoval medicínu na 1. lékařské fakultě UK v Praze a teoretickou informatiku na Matematicko-fyzikální fakultě UK; věnoval se také psychologii na Filozofické fakultě UK. Po studiích působil v Cold Spring Harbor Laboratory NY (USA), kde v roce 2007 obdržel titul Ph.D. v oboru neurobiologie.
Optogenetika je poměrně nová metoda, která přináší perspektivní možnosti, jak kontrolovat aktivity mozku. Co představuje a jaké okolnosti vedly k jejímu vzniku?
Jde o soubor technologií, které umožňují přesnou a selektivní kontrolu procesů probíhajících v buňkách. Nejde tedy o kontrolu genetické informace pomocí světla, ale o spojení optických a genetických technik, které vedou k aktivaci nebo deaktivaci specifických procesů ve vybraných buňkách živé tkáně. Tak jako genetici vypínají a zapínají specifické geny podle potřeby, tak optogenetici zapínají a vypínají definované procesy uvnitř buněk pomocí světla. V případě nervového systému jde nejčastěji o přesnou kontrolu aktivity definovaných skupin neuronů.
Snímání mozkové aktivity přineslo obrovské množství poznatků – např. jak jednotlivé části mozku reprezentují okolní svět. Abychom však byli schopni říct něco o kauzálním vztahu mezi pozorovanou aktivitou a kupříkladu chováním organismu, musíme mít možnost s částmi studovaného systému manipulovat. Klasické metody jako např. elektrická stimulace, farmakologická manipulace nebo chlazení bohužel nedokážou být zároveň cílené a dostatečně rychlé. Už v 70. letech minulého století Francis Crick vyslovil názor, že jedním z největších technických problémů věd o mozku je právě nalezení časově přesné a zároveň cílené manipulace mozkové aktivity u pouze jasně definované skupiny neuronů. Zhruba ve stejném čase se začaly objevovat studie popisující bakteriální iontové kanály a iontové pumpy reagující na světlo. Trvalo však několik desetiletí, než se tyto tzv. bakteriální opsiny začaly používat v neurovědách. Většinou se mělo za to, že bakteriální bílkoviny budou toxické pro neurony savců, a i kdyby ne, stejně budou vyžadovat kofaktor, jakým je kupříkladu all-trans retinal, který by se musel dodat. Kolem roku 2005 se však objevilo několik studií, které přesvědčivě ukázaly, že jeden z opsinů (iontový kanál channelrhodopsin-2) nejenom není toxický ve velkém množství a jeho kofaktor se z neznámých důvodů přirozeně vyskytuje v neuronech, ale především celý systém funguje přímo zázračně. Neurony, které jej obsahovaly, bylo možné aktivovat s milisekundovou přesností pomocí krátkých pulzů modrého světla, a to dokonce in vivo, tj. v živém mozku. Vedlo to doslova k explozi zájmu a v průběhu několika let se optogenetika stala jednou z dominantních experimentálních technik v neurovědách.
Optogenetických technik je více druhů, převládají ale technologie používající jednomolekulové opsiny, jakým je zmíněný channelrhodopsin-2, protože jsou jednodušší a hlavně výborně fungují. Optogenetika nepředstavuje synonymum pro kontrolu aktivity neuronů, velice slibné jsou též techniky využívající světlocitlivé modifikované receptory pro kontrolu vnitrobuněčné signalizace nebo techniky pro kontrolu aktivity jiných excitabilních tkání, např. svalů.
V současnosti je k dispozici celá řada molekul vhodných k aktivaci, deaktivaci, eventuálně přepínání aktivity neuronů. Tyto molekuly lze zvolit podle rychlosti aktivace/deaktivace nebo podle citlivosti na určitou barvu světla. Společně s prudkým rozvojem a poklesem cen molekulárně biologických technik můžeme zvolit cílovou skupinu neuronů pomocí genetických markerů anebo přímo označit typy neuronů u běžně dostupných transgenních myší a dopravit světlocitlivé opsiny do takto definovaných skupin neuronů např. pomocí upravených virů. Neurofyziologové tak mají k dispozici molekulární stavebnici, díky níž lze kombinací jednotlivých součástek vytvořit vlastní systém s možností bezprecedentně selektivní a zároveň časově přesné manipulace mozkové aktivity.

Vědci se odjakživa snažili ovlivnit cíleně funkci mozku, ať už pomocí léků, elektrické stimulace apod., což s sebou neslo i mnohé nepříznivé vedlejší účinky. Prokázaly se některé i v případě použití stimulace jednotlivých nervových buněk pomocí světelného paprsku?
Žádná experimentální technika není dokonalá a optogenetické manipulace můžou mít vedlejší účinky. Abychom mohli provést optogenetickou manipulaci, potřebujeme do buněk nejdříve vpravit cizí bílkovinu, např. iontový kanál. Přítomnost velkého množství cizích bílkovin, potřebných pro optogenetiku, může být pro buňku škodlivá. Tyto kanály dále začnou po stimulaci světlem propouštět ionty buněčnou membránou, což vede ke změnám vnitřního prostředí buněk, např. koncentrace vápníku nebo též pH ve specifických případech světlocitlivých protonových pump. Nezapomeňme ani, že samo světlo, které potřebujeme pro spuštění každé aktivace nebo deaktivace, může vést k zahřívání okolní tkáně, především když použi-jeme světlo o vyšším výkonu.
Naštěstí se ukazuje, že používané optogenetické opsiny jsou velmi dobře tolerovány, takže nic nestojí v cestě jejich běžnému využití u pokusných zvířat. Při obvyklých experimentálních postupech, v nichž se skupiny neuronů stimulují krátkodobě, v řádu milisekund až sekund, též nedochází k masivním změnám vnitřního prostředí buněk. Dlouhodobé stimulace, tj. v řádu týdnů, měsíců rozhodně nejsou běžné a je více než pravděpodobné, že budou vyžadovat změnu pokusných postupů. Jednoduše řečeno, když si vyberete neuron v mozku a rozhodnete se ho masivně a bez přerušení aktivovat, tak jej „odpálíte“ po několika minutách intenzivní stimulace.
Mnohem záludnější jsou „vedlejší účinky“ způsobené přehnanou interpretací výsledků optogenetických pokusů; jakkoli selektivní manipulace může zapříčinit nepředvídatelné následky, zejména v tak komplikovaném systému, jakým je mozek. Způsob, jakým aktivujeme nebo deaktivujeme neurony, může být velmi odlišný od skutečné neuronální aktivity; stimulace skupiny neuronů může vést ke kaskádovité aktivaci jiných skupin neuronů apod. I když optogenetika umožňuje velice přesnou manipulaci mozkové aktivity v čase i prostoru a posouvá nás od studování korelací ke studiu kauzálních vztahů, musíme dbát na správné interpretace výsledků experimentů. Např. aktivace skupiny neuronů naznačí něco o postačitelnosti, zatímco deaktivace skupiny neuronů vypovídá o nutnosti aktivity těchto neuronů pro studovaný jev.
Každý experimentátor musí znát meze své metody a mít je na paměti při plánování a realizaci pokusů. Optogenetická manipulace je jednou z experimentálních metod, kterými neurovědci odhalují tajemství mozku. V mnoha případech skutečně jde o fantastické zlepšení předchozích postupů. Optogenetika ale samozřejmě není všemohoucí – je vynikajícím sluhou, ovšem může být špatným pánem.

Ústav experimentální medicíny AV ČR patří mezi instituce, které se výrazně podílejí na výchově postgraduálních studentů. Tomáš Hromádka na snímku s Ondřejem Novákem (vpravo) a Ondřejem Zelenkou z Oddělení neurofyziologie sluchu ÚEM AV ČR.
Pokusy na myších a makacích od roku 2005 prokázaly, že optogenetická stimulace může nahradit elektrody při léčbě deprese a Parkinsonovy nemoci. S jakou „dávkou“ optimismu lze očekávat klinické spuštění?
Jde o pozoruhodnou ukázku toho, jak nová experimentální metoda posouvá naše poznání. Zároveň hovoříme o jednom z jejích prvních skutečně aplikovatelných použití. V případě tzv. hluboké stimulace mozku prostřednictvím implantovaných elektrod u Parkinsonovy nemoci nebylo vůbec jasné, proč v některých případech tak dobře funguje. Optogenetické experimenty ukázaly, že za účinky hluboké stimulace elektrodami neodpovídá aktivita předpokládané cílové struktury, ale aktivita nervových vláken vedoucích z jiných částí mozku, např. z motorické kůry. Teoreticky bychom tedy měli být schopni cíleně stimulovat jenom uvedenou skupinu nervových vláken, nebo ještě lépe skupinu jejich mateřských neuronů, a tak přesně odstranit symptomy Parkinsonovy nemoci bez vedlejších účinků.
Víme-li přesně, co stimulovat, ještě to neznamená, že víme jak stimulovat, tj. jakou aktivitu v těchto neuronech vyvolat, abychom dosáhli žádaného účinku. Tyto a podobné experimenty, např. při studiu mechanismů vzniku a průběhu schizofrenie, deprese apod., se proto stále uskutečňují.
Zabývám se především základním výzkumem, konkrétně pokusy na zvířatech. I když bych velice rád viděl praktické aplikace optogenetiky na lidech, technologie v současné podobě není na klinické aplikace zralá, protože je příliš invazivní. Vyžadovala by genovou terapii a operaci pro implantaci světlovodivých vláken. Složité situace, jaké představují metody dlouhodobé světelné aktivace hlubokých částí mozku, lze určitě řešit. Za největší překážku využití těchto metod u lidí však považuji aktuální nedostatek prokazatelně bezpečné metody pro doručení a dlouhodobou příto-mnost těchto velice užitečných, avšak stále cizorodých světločivých bílkovin do našich neuronů. Pokud se podaří „vyladit“ cílenou virovou aplikaci bílkovin, aby byla dlouhodobě bezpečná pro lidi, nic nebrání klinickému využití.
Optogenetika je ještě pořád mladá, v rozkvětu a na počátku své cesty. Vždyť první kompletní sada optogenetických nástrojů se objevila teprve kolem roku 2010; praktické a užitečné klinické použití bych proto čekal nejdříve v řádu let. Nové molekuly, postupy a jejich modifikace se objevují, když ne každý týden, tak určitě každý měsíc. Po technické stránce rozhodně není vše vyřešeno. Zkrátka nemáme v ruce kouzelný dálkový ovladač na mozek, byť se první pokusy o klinickou aplikaci objevují zejména v případech, kde není potřeba invazivních zásahů pro zacílení světla. Např. u lidí, kteří ztratili zrak v důsledku degenerativního onemocnění sítnice, se uvažuje o náhradě světločivých elementů sítnice novými světločivými opsiny genovou terapií.
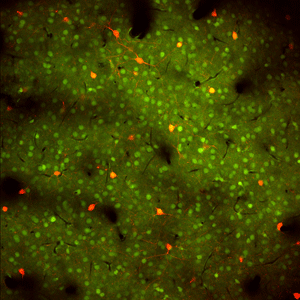
Foto: Ondřej Novák, Archiv ÚEM AV ČR
Část sluchové kůry myši; vrstva II/III, in vivo. Exprese červeného fluorescenčního proteinu TdTomato v somatostatin pozitivních inhibičních interneuronech – zelené barvení je kalciový indikátor OGB-1 AM. Strana obrázku v reálu 600 μm.
Mnohé laboratoře po celém světě, které se optogenikou zabývají, slibují procedury podobné těm z futuristických filmů. Kam až sahají hranice jejího využití?
Máte pravdu, některé aplikace rozhodně připomínají spíše science-fiction. Jako příklad uveďme pokusy, při kterých se v mozku myši označí neurony aktivní při zapamatování si bolestivého podnětu. Při následné optogenetické aktivaci pouze těchto neuronů hluboko v mozku se myš chová přesně tak, jako by se jí vybavily vzpomínky na původní podnět. S nadsázkou lze říci, že umělá aktivace vedla k „přehrání“ konkrétní paměťové stopy. Pochopitelně nevíme, co myš při této konkrétní aplikaci vnímá, protože zatím dokážeme posoudit jen vnější projevy, které zrcadlí vnitřní vjemy.
Optogenetika nyní slouží především jako velice jemný nástroj ke zkoumání neuronálních mechanismů, které vytvářejí základ našeho vnitřního světa.
Už identifikace alespoň základních změn v mechanismech provázejících např. psychiatrická onemocnění by otevřela cestu k selektivní a kauzální terapii. Jakmile se podaří v dostatečné míře odkrýt a pochopit mechanismy podílející se na utváření vnitřních vjemů, můžeme s bázní přikročit k manipulaci kognitivních stavů. Za předpokladu, že se to povede, jsou možnosti optogenetických manipulací značné. Vzhledem k tomu, že už nyní si můžeme zvolit specifické skupiny neuronů podle toho, jak vypadají, kde jsou, jaké geny obsahují, s kým komunikují, kdy jsou aktivní atd., lze si představit, že vhodnou stimulací bychom mohli do mozku vložit v podstatě libovolné vzorce aktivity. V tomto směru ale může optogenetika očekávat zdravou konkurenci od nanotechnologií, které by mohly být mnohem méně invazivní.
Další podnětnou teoretickou aplikací je oprava poškození nervových drah. Představte si, že by se signály přicházející k poškozenému místu zaznamenaly a s nepatrným časovým zpožděním „zkopírovaly“ pomocí světelných impulzů, které by vyvolaly požadovanou elektrickou aktivitu v nervových vláknech za poškozeným místem. Tímto způsobem by se poškozené místo v nervových dráhách aktivně „přemostilo“.
Je patrné, že využití této metody přinese i eventuální dalekosáhlé etické implikace.
Bezpochyby. Jednou si možná budeme muset klást otázku, co znamená mít úplnou kontrolu nad našimi vnitřními prožitky a emocemi. Do jaké míry smíme kontrolovat nejenom smyslové vnímání, ale třeba naději, touhu nebo smysl pro humor u nás nebo dokonce u jiných lidí. Všichni se asi shodneme, že by bylo žádoucí opravit nebo nahradit aktivitu v mozku poškozeném nemocí nebo úrazem. V jakém rozsahu bychom ale byli ochotni akceptovat vylepšování našich mentálních schopností? Na tyto, podle mne důležité otázky, neznám odpověď. Věřím, že se nám podaří odhalit tajemství mozku, a zároveň doufám, že ne.

Tomáš Hromádka (uprostřed), Ondřej Novák (vlevo) a Ondřej Zelenka z Oddělení neurofyziologie sluchu ÚEM AV ČR
Po návratu ze zahraničí působíte v laboratořích, které vede prof. Josef Syka. Čemu se konkrétně věnujete?
Zajímá mne především, jak jednotlivé typy neuronů spolupracují na vytváření vnitřní reprezentace okolního prostředí a jak výsledek této spolupráce posléze mozek používá k ovlivňování chování a rozhodování. Pro zpracování smyslové informace je pro nás vhodným modelem sluchový systém hlodavců.
Snažíme se zjistit, jak pracují a jakou funkci mají jednotlivé typy neuronů ve sluchové kůře, tj. části mozkové kůry, která se jako první podílí na zpracování sluchové informace. Ke zkoumání funkce mozkové kůry in vivo používáme kombinaci zobrazovacích, elektrofyziologických a zde nově zaváděných optogenetických technik. Právě kombinace monitorování stavby a aktivity mozkové kůry s možností přesné manipulace odhaluje funkci jednotlivých komponent, definovaných neuronů anebo neuronálních mikroobvodů.
Aktivitu a funkci neuronů monitorujeme jak ve zdravém mozku, tak i v mozku postiženém např. hlasitým zvukovým traumatem, což umožňuje vysvětlit podklad patofyziologických změn po selektivním poškození mozku. Rovněž pracujeme na „uzavření kruhu“, tj. poznání, jak přispívá pozorovaná aktivita a funkce sluchové kůry ve zdravém anebo poškozeném mozku k chování a rozhodovacím procesům zvířat. Víme-li totiž co a proč je v mozku špatně, máme větší šanci to „spravit“ anebo dokonce vylepšit.


 English
English