Do humánních ESC se vkládají velké naděje, a to zejména s ohledem na jejich potenciál diferenciace, a tím možnosti jejich využití v medicíně při léčení některých nemocí či následků úrazů. Pokud by však byly použity buňky odvozené z ESC derivovaných z jakéhokoliv embrya, je vysoce pravděpodobné, že by je tělo pacienta odmítlo, obdobně jako při transplantaci orgánu od namátkou vybraného dárce. Tomu by bylo možné předejít tím, že by bylo přenosem jádra somatické buňky od daného pacienta do enukleovaného oocytu (cytoplastu) vytvořeno embryo (a následně linie ESC), které by tak obsahovalo buňky kompatibilní s pacientem. Imunitní systém pacienta by pak tyto buňky nenapadal.
Při tvorbě lidských linií ESC se velmi často setkáváme s argumentem, že použití embrya vlastně znamená zničení života nového jedince. Při tvorbě kompatibilních linií by byla situace ještě komplikovanější, zde se navíc argumentuje možností vytvoření kopie (klonu) dárce jádra somatické buňky. Skutečným argumentem proti je spíš skutečnost, že oocyty lidí patří mezi jedny z nejvzácnějších buněk a je velmi obtížné je získat od dobrovolných dárkyň.
Z tohoto důvodu se začalo uvažovat o tom, že místo humánních oocytů by mohly být použity oocyty jiného druhu (např. skot, prase), a tím by byla otevřena možnost tvorby mezidruhových linií kmenových buněk. Kromě řady dosud nepoznaných biologických aspektů se však také i zde setkáváme s etickými argumenty, kdy je tento postup zásadně odmítán – jedním z nich je i ten, že není přípustné slučovat lidskou a zvířecí DNA. Z pohledu neetičnosti však tyto argumenty opomíjejí, že řada obdobných postupů se v humánní medicíně a biologii používá již po mnoho let, aniž by vyvolala nějaký odpor a diskuze. Příkladem mohou být hybridní buňky s cílem produkce monoklonálních protilátek, testování kvality některých parametrů lidských spermií jejich injekcí do oocytů zvířat apod. V našem příspěvku budeme diskutovat o některých biologických a etických aspektech produkce mezidruhových embryí a linií ESC. S ohledem na omezený prostor však nemůžeme v žádném případě kompletně pokrýt celou problematiku.
Můžeme vytvořit hybridní linie ESC?
Tvorba hybridního embrya představuje z technického hlediska jednoduchý a přímočarý postup, který není odlišný od běžného přenosu jader. Z oocytu od jednoho druhu vyjmeme chromosomy metafáze II, a tím připravíme cytoplast (enukleace). Do tohoto cytoplastu se pak přenese jádro somatické buňky jiného druhu, které se nachází zpravidla v G1 fázi. Pod vlivem cytoplasmatických aktivit cytoplastu dojde u přeneseného jádra k rozpadu jaderné membrány a ke kondenzaci chromosomů. Indukce kondenzace má zásadní význam pro reprogramování přenášeného jádra. Po určité době (1 až 2 hod.) jsou produkty přenosu uměle aktivovány – např. elektrickými pulsy, či působením SrCl2. Výsledkem je tvorba pseudo-prvojádra, které obsahuje jedno či více jadérek. Pokud bychom z těchto embryí chtěli získat linie ESC, musí se především vyvíjet až do stadia kvalitní blastocysty, která obsahuje zřetelný embryoblast (ICM) s dostatečným počtem buněk.
První publikace o ustavení hybridních ESC pochází z Číny z roku 2003. Jádra lidských somatických buněk byla přenášena do enukleovaných oocytů králíka. Vytvořená embrya se poměrně dobře vyvíjela až do stadia blastocysty a úspěšné bylo i ustavení několika linií ESC. Tyto výsledky pochopitelně vedly k tomu, že se řada pracovišť po celém světě snažila získat povolení k provádění obdobných pokusů s jasným cílem: zbavit se závislosti na zdroji lidských oocytů a získat linie ESC, které by byly kompatibilní s daným pacientem. Zároveň se však uvažovalo i o tom, že případné linie by byly vhodným materiálem pro testování farmakologických látek a případné genové manipulace. U farmakoterapií se kalkuluje se záměrnou tvorbou mezidruhových linií, které by byly vytvořeny tak, že by jádro somatické buňky od pacienta s určitou nemocí bylo přeneseno do enukleovaného oocytu, a tím by bylo zřejmé, že následně vytvořená linie ESC nese daný defekt. Na těchto liniích či diferencovaných buňkách by se pak mohla testovat příslušná farmaka či provádět genetické zásahy.
Je zcela logické, že záměrné vytváření lidských embryí s určitým defektem by nebylo vůbec akceptovatelné. Je ale nezbytné zdůraznit, že zopakovat výsledky čínské studie, to znamená ustavení mezidruhových linií ESC, se až do dnešní doby zatím nikomu nepodařilo. Existuje však řada výsledků, které naznačují, že za určitých okolností není cíl získání mezidruhových kmenových buněk pouhou "science fiction".
Je to především narození mezidruhových klonů muflona, gaura a dalších zvířat. Četné studie zabývající se mezidruhovým přenosem jader popisují vývoj takto rekonstruovaných embryí až do stadia blastocysty, byť v mnohem nižší frekvenci než při přenosech jader v rámci daného druhu. Ve většině případů se však vývoj rekonstruovaných embryí zastaví po několika děleních, zpravidla je to období, kdy embryo aktivuje svůj vlastní genom.
Je tak zřejmé, že je nezbytné se vrátit znovu k počátku a studovat vývoj mezidruhových embryí krok po kroku. Především jde o to najít tu nejvhodnější kombinaci, která bude optimální pro vývoj embrya přinejmenším do stadia blastocysty, kdy se v nejčastějších případech ESC derivují. Studium tak musí zahrnovat kompatibilitu jaderné a mitochondriální DNA, nukleolárního materiálu, centrosomů apod.
Jak jsme již uvedli výše, ESC byly derivovány především u myší, dále z lidských embryí a embryí primátů. Nejsou popsány linie ESC derivované z embryí hospodářských zvířat, a právě tento fakt může být velmi důležitý. Pro mezidruhové přenosy jader se především používají oocyty, které jsou relativně snadno dostupné – skot, prase (je s podivem, že se nevyužívají oocyty myší). Z hlediska požadavků na kultivace lze tak jen velmi těžko odhadnout, jak by se při derivaci ESC chovaly mezidruhové buňky embryoblastu. Mělo by rozhodující vliv jádro? Pak by byly kultivační podmínky obdobné těm, které se pro kultivaci lidských ESC používají v současné době. Nelze ale vyloučit, že by podstatný vliv mohla mít i cytoplasma. Pokud by pro přenos jádra byly použity oocyty skotu, bylo by v současné době v podstatě nemožné mezidruhovou linii ustavit, neboť u skotu nebyly dosud popsány odpovídající linie ESC.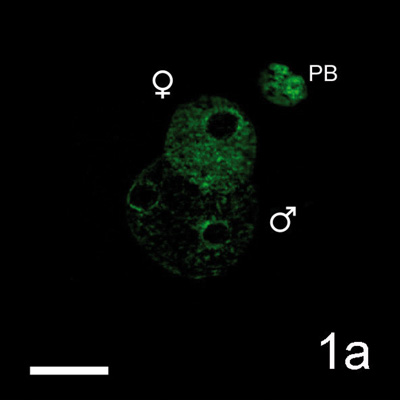
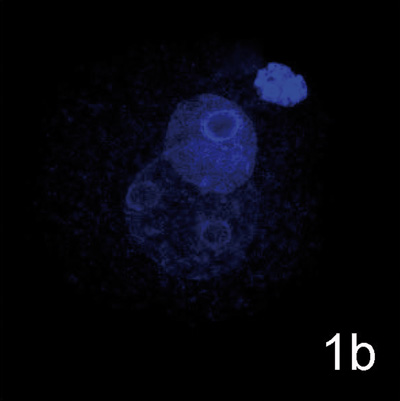
Intracytoplasmická injekce lidské spermie do oocytu myši. Zatímco je přenos jader lidských somatických buněk do oocytu jiného savčího druhu hodnocen jako diskutabilní z etického hlediska, injekce lidských spermií do oocytů jiných savčích druhů je posuzována jako "eticky akceptovatelná". Obr. 1a, b demnostruje dekondenzaci hlavičky lidksé spermie a tvorbu samčího prvojádra v oocytu myši: samčí prvojádro, samičí prvojádro - myš, druhé pólové tělísko (PB). 1a - značeno protilátkami proti acetylovanému H3K9, 1b - DAPI.
Mohou se rovněž vyskytnout námitky, že s ohledem na nedávné výsledky, kdy byly transdukcí čtyř faktorů (Oct 3/4, Sox2, c-myc a Klf4; včetně dalších modifikací) transformovány diferencované (a dokonce terminálně diferencované) buňky na buňky, které se svými vlastnostmi a potenciálem v podstatě neliší od pravých embryonálních kmenových buněk, nebude již nezbytné derivovat linie ESC ať již z normálních, či mezidruhových embryí, a tím se vyhneme i určitým etickým konfliktům. Je však diskutabilní, do jaké míry by tomu skutečně tak bylo, pokud dokážeme transformovat somatickou buňku na buňku pluripotentní (ekvivalentní embryonální buňce), není nemožné pak z těchto buněk vytvořit embryo. A pokud vytvoříme embryo…?
Je těžké odhadnout, jakým směrem se vývoj v dané oblasti bude ubírat. Nakonec o tom svědčí i rozhodnutí britského parlamentu z 20. května 2008, který mezidruhové přenosy jader povolil s tím, že se může jednat o zásadní krok pro budoucí léčbu a pochopení podstaty některých nemocí u lidí. Jisté je, že daný přístup přinese řadu zajímavých poznatků a může najít uplatnění i v dalších oblastech, jako je záchrana ohrožených druhů zvířat.
JOSEF FULKA jr., TIBOR MOŠKO, HELENA FULKOVÁ, EVA SYKOVÁ,
Centrum buněčné terapie a tkáňových náhrad 2. LF UK Praha


 English
English